Günlük yaşamımızda hepimiz yüzlerce kanser hücresi üretiriz. Ancak yapısal olarak normal hücrelerden farklı olan bu hücreleri bağışıklık sistemi yakalar ve yok eder. Ancak, kanser ilerledikçe kanser hücreleri bu savunma sistemine karşı görünmez olacak özellikler geliştirir.
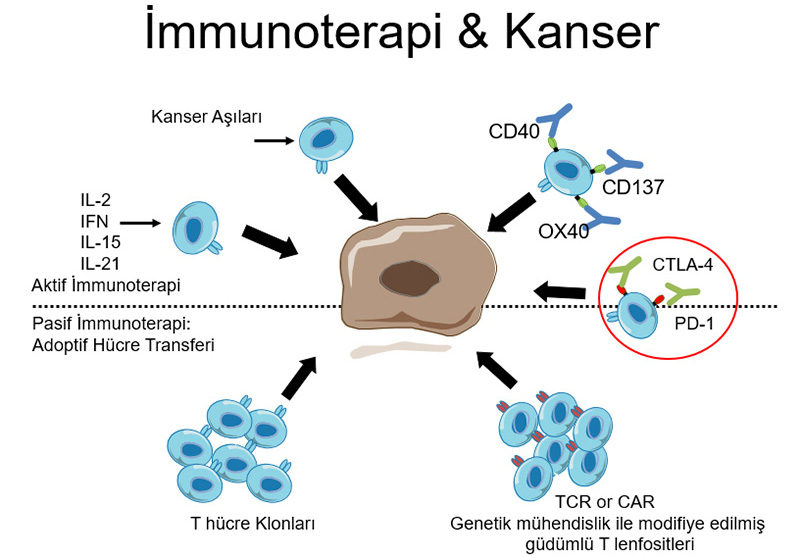
İmmunoterapi,konağın bağışıklık sistemini uyararak kansere karşı güdümleme anlamı taşır. İki çeşit immunoterapi şekli vardır:
Pasif
Kendi savunma sistemimizde yer alan (efektör) hücre veya vücudun ürettiği konvansiyonel silahlarla (sitokin perfüzyonu ile) kanser hücrelerine direkt saldırı
Aktif
Kanser antijenini çeşitli yollarla bağışıklık sistemine tanıtarak kanser hücresine güdümlü konak savunma sistemi oluşturmak
Son yıllarda kanserli hücrelerin konağın bağışıklık sistemini baskılayan bazı doğal hücresel yapıları harekete geçirdiği saptandı (CTLA-4 & PD-1 gibi)...
IL, interleukin; IFN, interferon; TCR, T-cell receptor; CAR, chimeric antigen receptor; PD1, programmed death 1; CTLA-4, cytotoxic T-lymphocyte-associated protein 4.
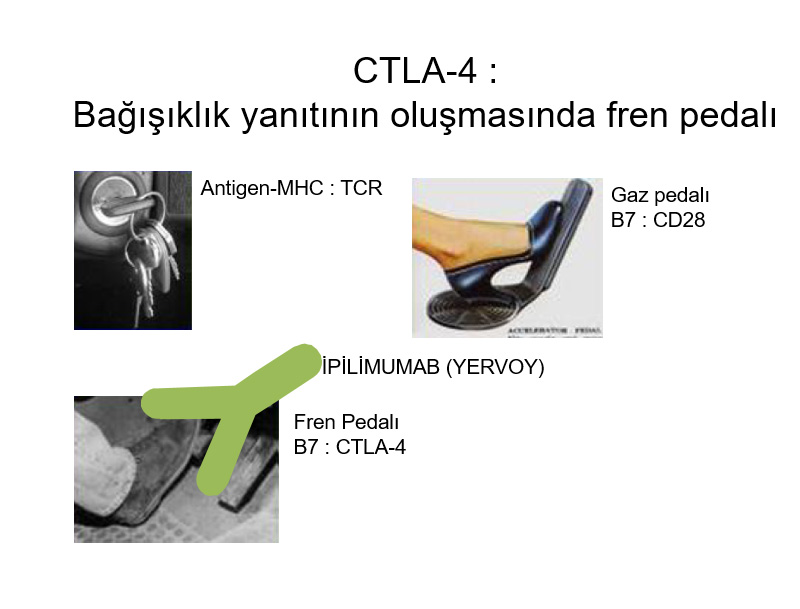
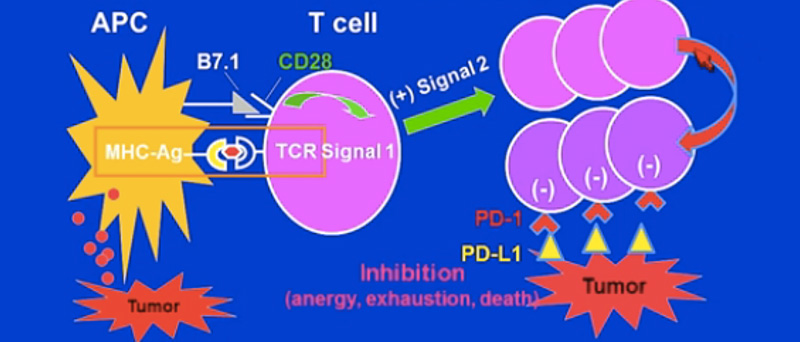
Kansere karşı bağışıklık yanıt iki aşamada gerçekleşir. Genellikle kanserli dokunun en yakınında yer alan ilk lenf düğümünde oluşan “Priming fazı” adı verilen ilk aşamada kanser hücresi bağışıklık sistemine tanıtılır. Bu tanıtım işlemi sırasında özel bazı hücresel moleküllerin birbirleriyle iletişimi çok önem taşır. Örneğin, B7 ve B28 adlı moleküllerin birbirleriyle kenetlenmesi gerekirken, arada yer alan CTLA-4 isimli bir baska molekülün bu kenetlemeyi engellemesi ilk tanıtım aşamasını engeller. Bu engelleme işlevi aslında vücudun bağışıklık sisteminin kendi organlarımıza zarar vermesini engelleyen doğal bir reaksiyondur. Ancak, kanser söz konusu olduğunda bu durum kanserin lehine işlemektedir.
İlk aşama başarıyla sonuçlandığında, daha uzak dokularda ve tümör etrafı dokularda “efektör faz” adı verilen ikinci basamak aşama başlar. Bu durumda konağın asker hücreleri olan “T lenfositleri” artık kanser hücrelerine güdümlenmişlerdir. T lenfositlerinin kanserli hücreleri başarılı bir şeklide yok edebilmeleri için de yine ara bağlantı uzantılarının birbirleriyle kenetlenmeleri gerekir. Ancak, bu sırada tümör hücreleri tarafından üretilen PD-L1 maddesi T lenfositleri yüzeyinde bulunan PD-1 duyargasına bağlanırsa bu kenetlenme işlevi engellenir. Bu şekilde kanser hücresi bağışıklık sisteminin savunma etkisinden kaçmış olur.
MHC, major histocompatibility complex; TCR, T-cell receptor; PD-1, programmed death 1; PD-L1 programmed death ligand 1; CTLA-4, cytotoxic T-lymphocyte-associated protein 4.
İmmun kontrol noktası (checkpoint) blokajı yapan tedavilerin özellikleri:
- Kanser hücresini direkt olarak hedeflemez
- Kanser aşısı veya bağışıklık sistemi habercisi olan sitokinler gibi konak bağışıklık yanıtını arttırmaya çalışmaz
- Bağışıklık sisteminin etkisini duruduran fren mekanizmalarını bozar
Bu mekanizma üzerinden etki göstererek ilk onaylanan ilaç melanom isimli cilt kanserini durduran “ipilimumab (Yervoy) adlı ilaçtır. İpilimumab bağışıklık sistemine fren yapan CTLA-4: B7 baglantısını engelleyerek etkili olur.
2011 de ipilimumab’ın onaylanmasını takiben başka mekanizma üzerinden aynı etkiyi yapan farklı ilaçlar da geliştirilmiştir.
CTLA-4, cytotoxic T-lymphocyte-associated protein 4; MHC, major histocompatibility complex; TCR, T-cell receptor.
PD-L1 Kontrol Noktası:
Bağışıklık sistemine saldırı sırasında ilk savunma hattı
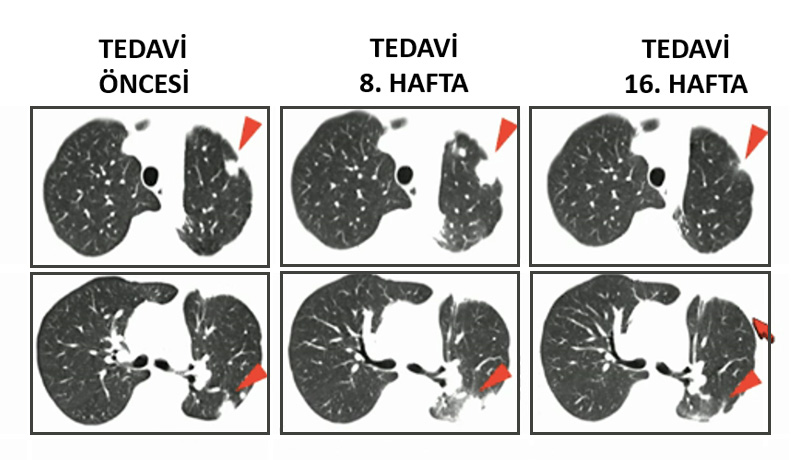
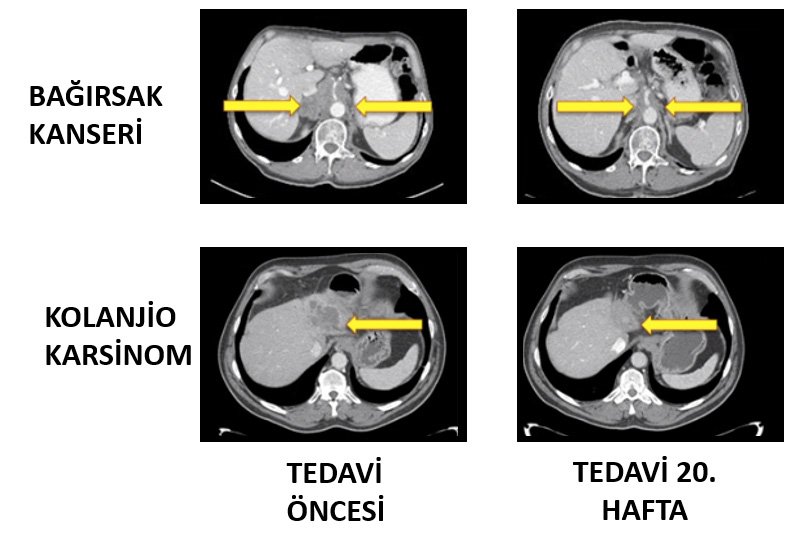
Immun kontrol noktasını (Immun Chek-point) oluşturan PD-1: PD-L1 bağlantısını keserek etki eden bu ilaçlar başarılı sonuçları nedeniyle günümüzde malin melanom, yassı epitel hücreli akciğer kanseri ve renal hücreli karsinom gibi tedavisi çok zor olan hastalıklarda onaylanmışlardır ve aralarında hodgkin lenfoma, mesane, over (yumurtalık), mide, baş-boyun kanseri, bağırsak kanserleri, pankreas ve kolanjio karsinom gibi pekçok onkolojik hastalıkta çalışmaları devam etmektedir.
Örneğin, ilk akciğer kanserli insan çalışmasında bu tedaviyle 2 ay içinde alınan yanıt hasta filmlerinde görüldüğü gibi kayıtlara geçmiştir.
Tedaviye Dirençli Melanomlu Hastada Anti PD-1 Tedavi ile Sonuç
72 yaşında daha önce yüksek doz İnterferon, ve İpilimumab ile tedavi edilip hastalığı ilerlemiş bir hastada yeni nesil PD-1 tedavisi ile elde edilen başarılı sonuç bu şeklide kayıtlara geçmiştir.
HD, high dose; IL-2, interleukin-2.
Yanıt Değerlendirme
Bu ilaçlarda kemoterapi sırasında çok alışageldiğimiz gibi erken dönemde yanıt görmeyi beklemiyoruz. İlk yanıt değerlendirme için en az 3-4 ayın geride kalması gerekmektedir. Çünkü, ilk 2 ayda bağışıklık sisteminin oluşturduğu yoğun inflamatuvar yanıt nedeniyle tümör aslında büyümüş gibi görünebilir.
Özel Genetik Alt-Tip ve Tedavi Yanıt İlişkisi
Biyolojik tedavilerde etkili olmak için anahtarın kilite tam uyması gerekir. Bu nedenle, çok pahalı olan bu tedavilerin tam olarak etkili olabileceği hastalık alt-gruplarının belirlenmesi büyük önem taşımaktadır. Örneğin, mikrosatellit instabilite sergileyen standart kemoterapi sonrası ilerlemiş bağırsak kanserli ve tedaviye çok dirençli bir hastalık olan safra yolu kanserinde bu grup ilaçlarla çok ümit verici sonuçlar bldirilmiştir. Uygun hasta gruplarının belirlenmesi için birçok çalışma sürmektedir.
Kanserde İmmunoterapi Konusunda Gelecek Hedefler
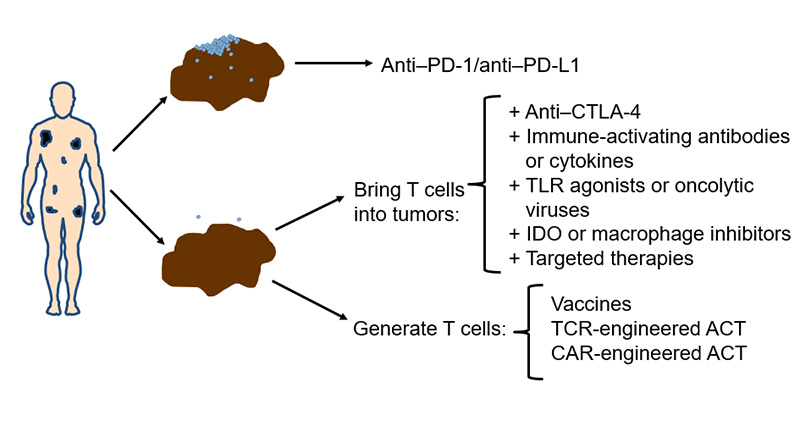
Kanserde immunoterapi konusunda birçok yeni strateji geliştirme aşamasındadır. Bunlar arasında; bağışıklık sisteminin askerleri olan T hücelerini kanserli hücrelere getirecek veya yeni güdümlü T hücreleri üretmeye yönelik girişimler gelecekte çok başarılı sonuçlar getirme potansiyaline sahip yaklaşımlar arasında sayılmaktadırlar. Özellikle PD-1 veya PD-L1 hedefli ilaçlara direnç söz konusu olduğunda bu ilaçları anti-CTLA4 ajanlar veya PD-1, PD-L1 duyarlılığını arttıracak bazı kanser aşıları veya GM-CSF gibi hücreleri (IFN-gamma) uyaran habercilerle birlikte kullanmak; veya farklı bir strateji olarak kanser hücrelerine karşı genetik mühendislik yolu ile güdümlenmiş T hücre duyargaları (TCR veya CAR) ile tedaviler konusunda yürütülmekte olan birçok çalışma bulunmaktadır.
PD-1, programmed death 1; PD-L1, programmed death ligand 1; CTLA-4, cytotoxic T-lymphocyte-associated protein 4; TLR, toll-like receptor; IDO, indoleamine-pyrrole 2,3-dioxygenase; CAR, chimeric antigen receptor; ACT, adoptive cell transfer.
Günlük yaşamımızda hepimiz yüzlerce kanser hücresi üretiriz. Ancak yapısal olarak normal hücrelerden farklı olan bu hücreleri bağışıklık sistemi yakalar ve yok eder. Ancak, kanser ilerledikçe kanser hücreleri bu savunma sistemine karşı görünmez olacak özellikler geliştirir.
İmmunoterapi,konağın bağışıklık sistemini uyararak kansere karşı güdümleme anlamı taşır. İki çeşit immunoterapi şekli vardır:
Pasif
Kendi savunma sistemimizde yer alan (efektör) hücre veya vücudun ürettiği konvansiyonel silahlarla (sitokin perfüzyonu ile) kanser hücrelerine direkt saldırı
Aktif
Kanser antijenini çeşitli yollarla bağışıklık sistemine tanıtarak kanser hücresine güdümlü konak savunma sistemi oluşturmak
Son yıllarda kanserli hücrelerin konağın bağışıklık sistemini baskılayan bazı doğal hücresel yapıları harekete geçirdiği saptandı (CTLA-4 & PD-1 gibi)...
IL, interleukin; IFN, interferon; TCR, T-cell receptor; CAR, chimeric antigen receptor; PD1, programmed death 1; CTLA-4, cytotoxic T-lymphocyte-associated protein 4.
Kansere karşı bağışıklık yanıt iki aşamada gerçekleşir. Genellikle kanserli dokunun en yakınında yer alan ilk lenf düğümünde oluşan “Priming fazı” adı verilen ilk aşamada kanser hücresi bağışıklık sistemine tanıtılır. Bu tanıtım işlemi sırasında özel bazı hücresel moleküllerin birbirleriyle iletişimi çok önem taşır. Örneğin, B7 ve B28 adlı moleküllerin birbirleriyle kenetlenmesi gerekirken, arada yer alan CTLA-4 isimli bir baska molekülün bu kenetlemeyi engellemesi ilk tanıtım aşamasını engeller. Bu engelleme işlevi aslında vücudun bağışıklık sisteminin kendi organlarımıza zarar vermesini engelleyen doğal bir reaksiyondur. Ancak, kanser söz konusu olduğunda bu durum kanserin lehine işlemektedir.
İlk aşama başarıyla sonuçlandığında, daha uzak dokularda ve tümör etrafı dokularda “efektör faz” adı verilen ikinci basamak aşama başlar. Bu durumda konağın asker hücreleri olan “T lenfositleri” artık kanser hücrelerine güdümlenmişlerdir. T lenfositlerinin kanserli hücreleri başarılı bir şeklide yok edebilmeleri için de yine ara bağlantı uzantılarının birbirleriyle kenetlenmeleri gerekir. Ancak, bu sırada tümör hücreleri tarafından üretilen PD-L1 maddesi T lenfositleri yüzeyinde bulunan PD-1 duyargasına bağlanırsa bu kenetlenme işlevi engellenir. Bu şekilde kanser hücresi bağışıklık sisteminin savunma etkisinden kaçmış olur.
MHC, major histocompatibility complex; TCR, T-cell receptor; PD-1, programmed death 1; PD-L1 programmed death ligand 1; CTLA-4, cytotoxic T-lymphocyte-associated protein 4.
İmmun kontrol noktası (checkpoint) blokajı yapan tedavilerin özellikleri:
- Kanser hücresini direkt olarak hedeflemez
- Kanser aşısı veya bağışıklık sistemi habercisi olan sitokinler gibi konak bağışıklık yanıtını arttırmaya çalışmaz
- Bağışıklık sisteminin etkisini duruduran fren mekanizmalarını bozar
Bu mekanizma üzerinden etki göstererek ilk onaylanan ilaç melanom isimli cilt kanserini durduran “ipilimumab (Yervoy) adlı ilaçtır. İpilimumab bağışıklık sistemine fren yapan CTLA-4: B7 baglantısını engelleyerek etkili olur.
2011 de ipilimumab’ın onaylanmasını takiben başka mekanizma üzerinden aynı etkiyi yapan farklı ilaçlar da geliştirilmiştir.
CTLA-4, cytotoxic T-lymphocyte-associated protein 4; MHC, major histocompatibility complex; TCR, T-cell receptor.
PD-L1 Kontrol Noktası:
Bağışıklık sistemine saldırı sırasında ilk savunma hattı
Immun kontrol noktasını (Immun Chek-point) oluşturan PD-1: PD-L1 bağlantısını keserek etki eden bu ilaçlar başarılı sonuçları nedeniyle günümüzde malin melanom, yassı epitel hücreli akciğer kanseri ve renal hücreli karsinom gibi tedavisi çok zor olan hastalıklarda onaylanmışlardır ve aralarında hodgkin lenfoma, mesane, over (yumurtalık), mide, baş-boyun kanseri, bağırsak kanserleri, pankreas ve kolanjio karsinom gibi pekçok onkolojik hastalıkta çalışmaları devam etmektedir.
Örneğin, ilk akciğer kanserli insan çalışmasında bu tedaviyle 2 ay içinde alınan yanıt hasta filmlerinde görüldüğü gibi kayıtlara geçmiştir.
Tedaviye Dirençli Melanomlu Hastada Anti PD-1 Tedavi ile Sonuç
72 yaşında daha önce yüksek doz İnterferon, ve İpilimumab ile tedavi edilip hastalığı ilerlemiş bir hastada yeni nesil PD-1 tedavisi ile elde edilen başarılı sonuç bu şeklide kayıtlara geçmiştir.
HD, high dose; IL-2, interleukin-2.
Yanıt Değerlendirme
Bu ilaçlarda kemoterapi sırasında çok alışageldiğimiz gibi erken dönemde yanıt görmeyi beklemiyoruz. İlk yanıt değerlendirme için en az 3-4 ayın geride kalması gerekmektedir. Çünkü, ilk 2 ayda bağışıklık sisteminin oluşturduğu yoğun inflamatuvar yanıt nedeniyle tümör aslında büyümüş gibi görünebilir.
Özel Genetik Alt-Tip ve Tedavi Yanıt İlişkisi
Biyolojik tedavilerde etkili olmak için anahtarın kilite tam uyması gerekir. Bu nedenle, çok pahalı olan bu tedavilerin tam olarak etkili olabileceği hastalık alt-gruplarının belirlenmesi büyük önem taşımaktadır. Örneğin, mikrosatellit instabilite sergileyen standart kemoterapi sonrası ilerlemiş bağırsak kanserli ve tedaviye çok dirençli bir hastalık olan safra yolu kanserinde bu grup ilaçlarla çok ümit verici sonuçlar bldirilmiştir. Uygun hasta gruplarının belirlenmesi için birçok çalışma sürmektedir.
Kanserde İmmunoterapi Konusunda Gelecek Hedefler
Kanserde immunoterapi konusunda birçok yeni strateji geliştirme aşamasındadır. Bunlar arasında; bağışıklık sisteminin askerleri olan T hücelerini kanserli hücrelere getirecek veya yeni güdümlü T hücreleri üretmeye yönelik girişimler gelecekte çok başarılı sonuçlar getirme potansiyaline sahip yaklaşımlar arasında sayılmaktadırlar. Özellikle PD-1 veya PD-L1 hedefli ilaçlara direnç söz konusu olduğunda bu ilaçları anti-CTLA4 ajanlar veya PD-1, PD-L1 duyarlılığını arttıracak bazı kanser aşıları veya GM-CSF gibi hücreleri (IFN-gamma) uyaran habercilerle birlikte kullanmak; veya farklı bir strateji olarak kanser hücrelerine karşı genetik mühendislik yolu ile güdümlenmiş T hücre duyargaları (TCR veya CAR) ile tedaviler konusunda yürütülmekte olan birçok çalışma bulunmaktadır.
PD-1, programmed death 1; PD-L1, programmed death ligand 1; CTLA-4, cytotoxic T-lymphocyte-associated protein 4; TLR, toll-like receptor; IDO, indoleamine-pyrrole 2,3-dioxygenase; CAR, chimeric antigen receptor; ACT, adoptive cell transfer.